北京博奥森生物技术有限公司品牌商
10 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
科学前沿——新冠病毒致病新机制,这个病毒太全能!
1017 人阅读发布时间:2020-11-12 09:07

SARS-CoV-2核衣壳蛋白(nCoVN)作为一种潜在的疫苗和治疗靶点,在病毒基因组包装和病毒自组装中发挥着重要作用。2020年3月27日,广东省Beating Origin再生医学有限公司,中山大学,广州医科大学等多机构合作在MedRxiv在线发表题为“The Nucleocapsid Protein of SARS-CoV-2 Abolished Pluripotency in Human Induced Pluripotent Stem Cells”的研究论文,研究表明,nCoVN对iPSC的生理活性及多能性都有影响。

文章背景
根据目前对SARS-CoV生命周期的认识,核衣壳蛋白由宿主细胞翻译表达,主要定位于胞浆。核衣壳蛋白的主要功能是将病毒基因组包装进核衣壳以保护基因组RNA。在核衣壳形成过程中,大量的核衣壳蛋白与病毒RNA结合并寡聚。病毒的繁殖策略是尽可能多地合成核衣壳蛋白,以满足病毒组装的需要,这就意味着核衣壳蛋白会生产过剩,而冗余的核衣壳蛋白会干扰宿主细胞的正常生理活动。
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)是COVID-19的病原体,与SARS-CoV的基因组同源性为79%。预测SARS-CoV-2共有12个编码区,包括刺突蛋白、核衣壳蛋白、包膜蛋白和膜蛋白。越来越多的证据表明,SARS-CoV-2的刺突蛋白通过与人ACE2结合进入宿主细胞,表明SARS-CoV-2可能与SARS-CoV具有相似的致病机制。
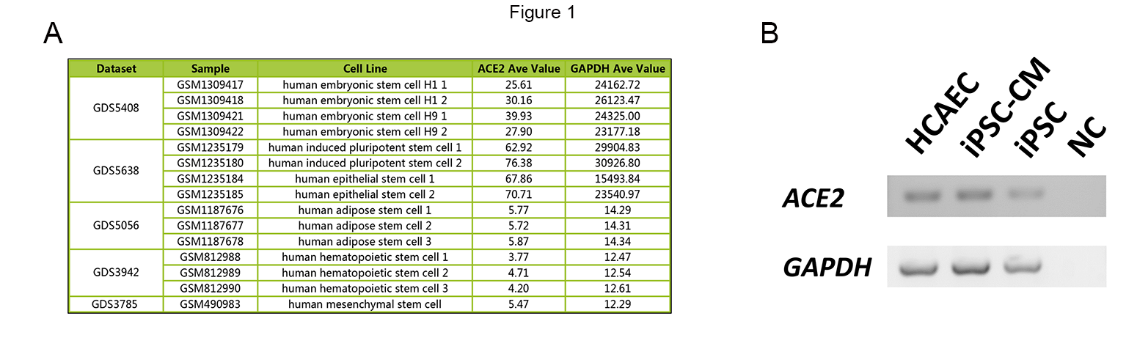
ACE2在多种干细胞中表达
由于ACE2是细胞膜上SARS-CoV-2的主要受体,研究首先检测了ACE2是否在干细胞中表达。图1A显示了不同项目的不同干细胞中ACE2的表达值,包括人类胚胎干细胞、iPSC、人类上皮干细胞、人类脂肪干细胞、人类造血干细胞和人类间充质干细胞。同时收集housekeeping基因GAPDH的表达值作为对照。ACE2在不同类型的干细胞中均有表达,但与GAPDH相比表达量相对较低。逆转录聚合酶链反应(RT-RCR)结果显示ACE2在iPSC、iPSC衍生心肌细胞(iPS -CM)和人冠状动脉内皮细胞(HCAEC)中表达,提示这些细胞是SARS-CoV-2的潜在靶点(图1B)。
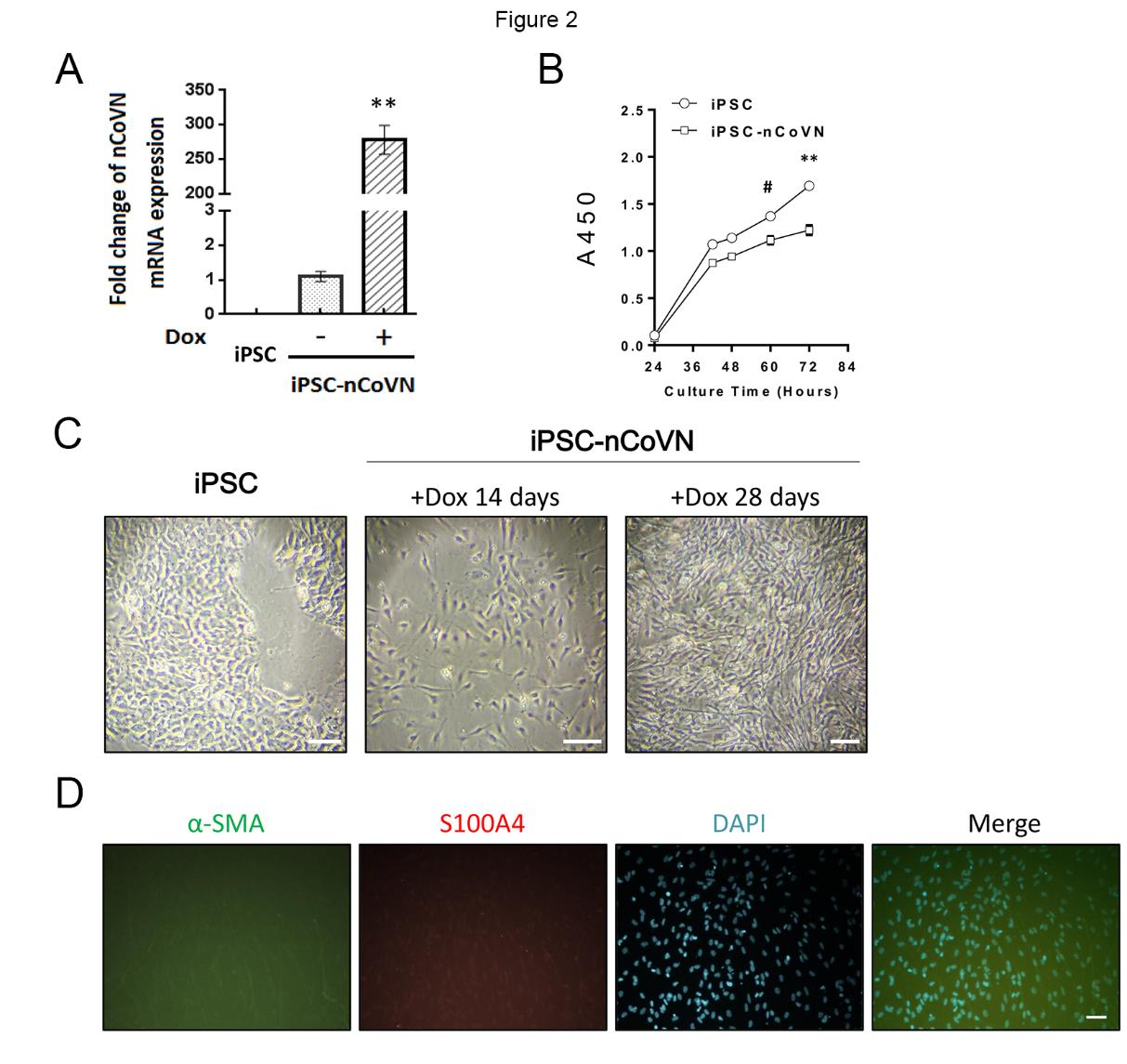
nCoVN的过度表达促使iPSC向成纤维细胞分化
为了研究nCoVN是否干扰iPSC的生理活性,该研究采用慢病毒表达系统建立了一种诱导性多能干细胞系(iPSC-nCoVN),在该系统中,nCoVN的cDNA序列转录依赖于Dox的诱导。经普罗霉素筛选后,iPSC-nCoVN分为两组:一组用Dox诱导nCoVN表达(Dox+),另一组用DMSO作为对照组(DMSO+)。实时PCR检测iPSC、Dox+和DMSO+组nCoVN的转录水平。在Dox+组中,nCoVN的表达增加了267倍(图2A)。用细胞计数试剂-8比较iPSC组和Dox+组的增殖率。细胞接种3天后,iPSC的增殖率高于Dox+组,说明nCoVN可能阻碍iPSC的生长和分裂(图2B)。继续在iPSC中诱导nCoVN的表达,7天后,一些亚克隆的形态开始改变;诱导14天后,大多数细胞呈现出与野生型iPSC不同的形态;诱导28天后,出现典型的成纤维细胞样形态(图2C)。用抗成纤维细胞标志物α-SMA (Bioss, bsm-33187M, 鼠单抗)和S100A4 (Bioss, bs-3759R, 兔多抗)的抗体来验证这些成纤维细胞样细胞的类型,免疫荧光分析结果证实Dox+细胞已转变为成纤维细胞(图2D)。
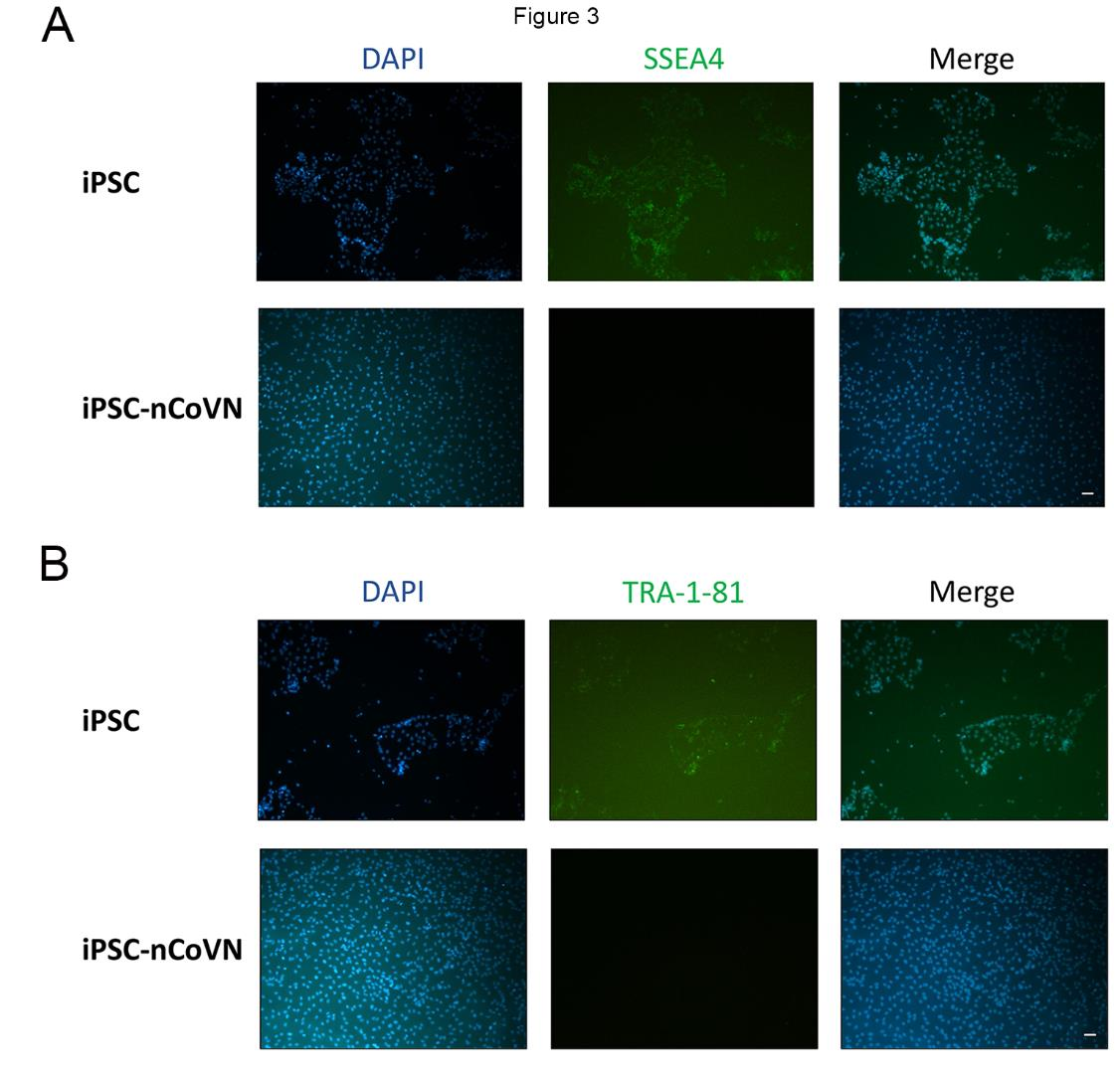
nCoVN的过表达抑制了iPSC的多能性
接下来,研究检测了iPSC和iPSC-nCoVN中的多能性标记。多能性标记SSEA4和TRA-1-81在人胚胎干细胞和iPSC的细胞膜上表达,广泛应用于多能性干细胞的鉴定。免疫荧光分析获得的图像清楚地说明,iPSC-nCoVN完全失去了SSEA4和TRA-1-81的表达,即iPSC-nCoVN在nCoVN存在的情况下失去了多能性(图3)。
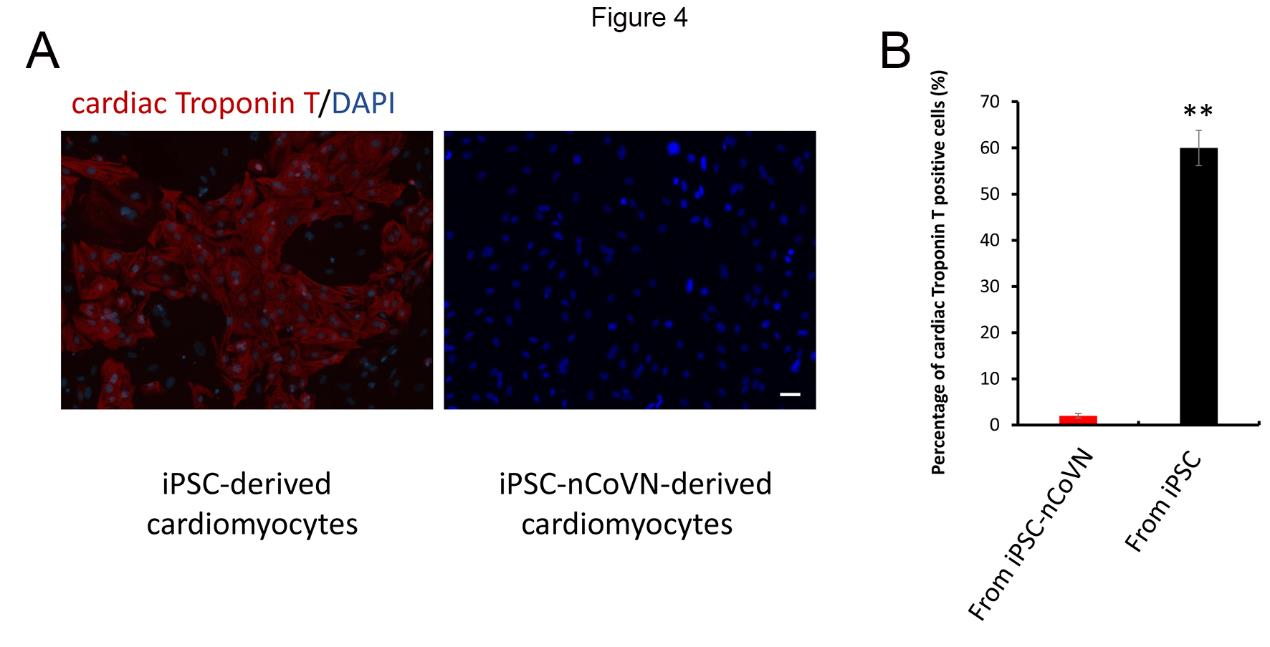
为了进一步检测iPSC和iPSC-nCoVN的多能性,研究者又采用常规方法在相同条件下将这些细胞直接分化为心肌细胞。正如预期的那样,iPSC的分化效率可以达到60%;然而,在分化第12天,只有很小的一部分细胞表达了心肌肌钙蛋白T,同时伴随着大多数细胞死亡(图4)。这种分化实验提供了确凿的证据,证明nCoVN破坏了iPSC-nCoVN的多能性维持。
面对如此狡猾又“全能”的病毒,当前甚至很长一段时间内,我们都将处于缺乏新冠药,没有百分百有效的预防措施和疫苗的阶段。未来我们要做的是:勇于接受挑战,客观评估风险,科学调整管控级别,学会与新冠长期共存。在采取规范的预防措施的同时,恢复正常的生活秩序。