北京博奥森生物技术有限公司品牌商
10 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
免疫细胞分型常见标志物—NK细胞分型标志物
1632 人阅读发布时间:2021-10-26 11:22


自然杀伤细胞(Natural killer,NK) 是细胞毒性淋巴细胞的一种类型,是天然免疫系统的主要组成部分。NK细胞在肿瘤和病毒感染细胞的宿主排斥反应中起重要作用。它们之所以被命名为“Natural killer”,是因为最初认为它们不需要激活就能杀死“缺失自我识别”的细胞(“缺失自我识别”是用来描述MHC-I类细胞表面标记表达水平较低的细胞,这种情况可能是由病毒感染引起的,或者是在杀伤T细胞的强选择压力下发生的)。
NK细胞与ILC1s(1型天然淋巴细胞)具有许多相似特征,包括转录因子T-bet的表达、活化诱导的IFNγ和TNFα的产生,但NK细胞还表达转录因子Eomes以及granzyme B和performin,而ILC1s不表达。因此,NK细胞更被认为是CD8+T细胞在天然免疫系统里的对应细胞。
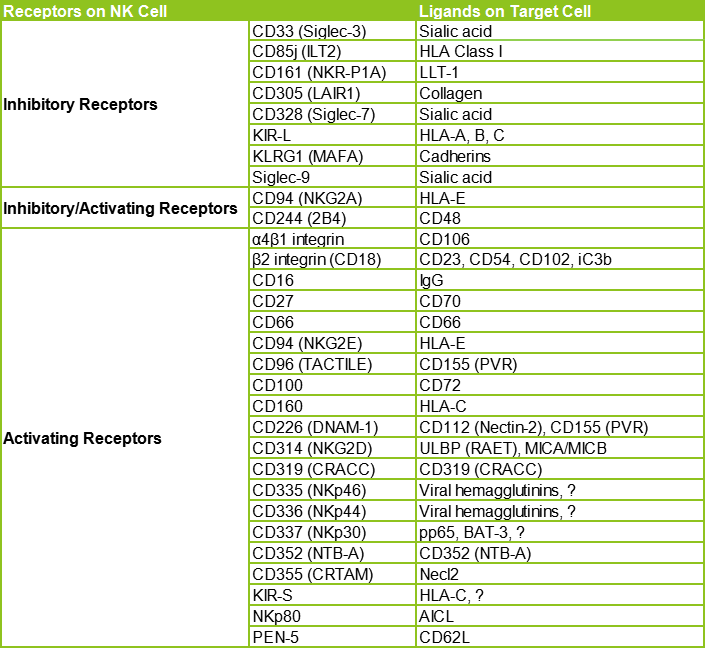
NK细胞的功能由多种细胞表面受体控制,这些受体要么具有激活的细胞毒性功能,要么具有免疫调节作用1,这些受体分类见下表1a和1b。NK细胞的细胞毒性受激活和抑制信号相互作用的调节,抑制性受体通过识别自身MHC-I类分子来阻止NK细胞的激活。
图1a:人NK表面受体的分类
人NK细胞常用的分型标志物
CD56
CD56,又被称作神经细胞相关粘附分子(NCAM),在人NK细胞上的表达强度被视为一种功能指标。在血液中,我们至少鉴定出NK细胞的两个主要群体2:CD56Dim(CD56表达水平较低)和 CD56bright(CD56表达水平较高)。一般认为,CD56Dim NK细胞(占NK细胞总数90%)是细胞毒性的,CD56bright的NK细胞(占NK细胞总数10%)是抑制性的 (产生细胞因子)2。
CD16
另一个典型的NK细胞标志CD163,又称作FCγRIII,是一种激活受体,它能产生ADCC现象(抗体依赖的细胞毒性)4。CD16表达增强NK细胞对抗体调理细胞的识别能力并直接杀死这些细胞5。
人NK细胞分化或功能标志物
最后,尽管NK细胞一直被认为是先天免疫系统的成员,但新的越来越多的证据表明,NK细胞可以表现出一些通常归因于适应性免疫细胞的特征,如亚群的扩张和收缩、寿命的延长以及对同一抗原(类似记忆的特性)的第二次识别时出现更有力的反应19。
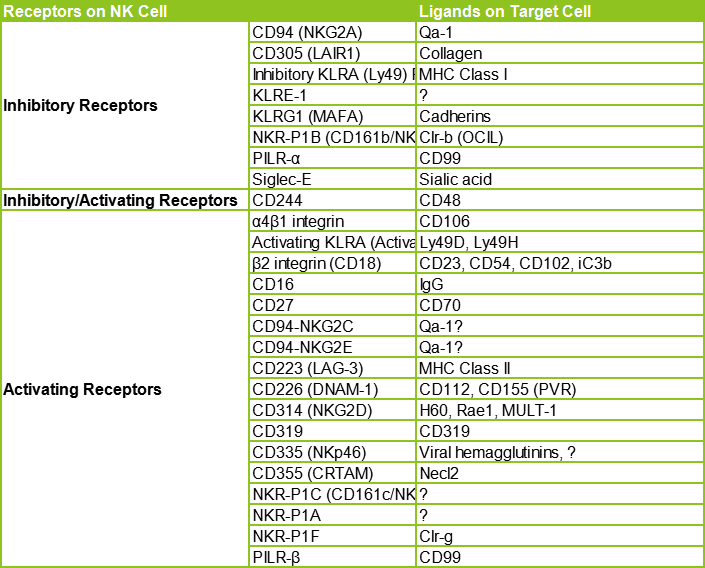
小鼠NK细胞常用的分型标志物
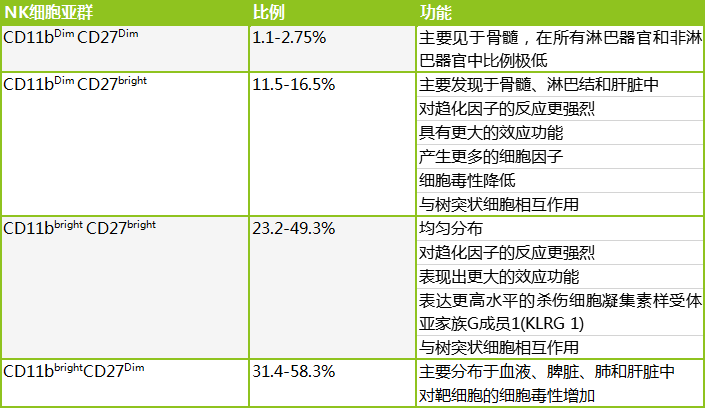
图2:小鼠NK细胞的四个亚群
| 英文名称 | 产品编号 | 应用 | PubMed |
| B3GAT1 | bs-1635R | WB, ELISA, IHC, FC, IF | 2 |
| CD11b | bs-1014R | WB, ELISA, IHC, FC, IF | 26 |
| bs-11127R | ELISA | - | |
| CD16 | bs-6028R | WB, ELISA, IHC, FC, IF | 5 |
| bsm-33096M | WB, ELISA | - | |
| CD27 | bs-23615R | WB, ELISA | - |
| bs-2491R | WB, ELISA | 1 | |
| bsm-54318R | WB, IHC, ICC | - | |
| CD56 | bs-0736R | WB, ELISA, IHC, IF | 2 |
| bs-0805R | WB, ELISA, IHC, FC, IF, ICC | 2 | |
| bsm-51499M | WB | - | |
| CD94 | bs-2521R | WB, ELISA | - |
| Integrin alpha 2 | bs-10132R | WB, ELISA, ICC | 1 |
| bs-2635R | WB, FC | - | |
| bsm-52613R | WB, IHC, IF, ICC | - | |
| NCR1 | bs-10027R | WB, ELISA | 3 |
| bs-21362R | WB, ELISA | - | |
| bs-23550R | WB, ELISA, IHC, FC, IF, ICC | - | |
| bs-41214R | WB | - |
*产品信息以官网为准:www.bioss.com.cn
参考文献:
1.Mandal A and Viswanathan C (2014) Hematology/Oncology and Stem Cell Therapy. 8, 47-55
2.Caligiuri MA, Blood, (2008)112:461-469
3.Hanna J et al, Trends Immunol, (2007) 28:201-206
4.Perussia B, Curr Top Microbiol Immunol, (1998) 63-88
5.Marquez ME et al, Cellular Immunology, (2010) 264:86-92
6.Béziat V, et.al, J Immunol. (2011) 186(12):6753-61
7.Bjorkstrom NK, et.al, Blood (2010) 116(19):3853–64
8.Lopez-Verges S, et.al, Blood (2010) 116(19):3865–74
9.Vitale M,et.al, Int Immunol (1999) 11(1):29–35
10Marcenaro E, et.al, Immunotherapy (2011) 3(9):1075–86
11.Sivori S, et.al, Eur J Immunol (1999) 29(5):1656–66
12.Gonzalez VD, et.al, Clin Immunol (2008) 128(1):46–56
13.Gonzalez VD, et.al, J Immunol (2009) 183(10):6612–8
14.Della Chiesa M, et.al, Blood (2012) 119(2):399–410
15.Bjorkstrom NK, et.al, J Exp Med (2011) 208(1):13–21
16.Nguyen S, et.al, J Neuroimmunol (2006) 179(1–2):117–25
17.Lugli E, Marcenaro E, Mavilio D.Front Immunol (2014) 5:390
18.Bjorkstrom NK, Ljunggren HG, Sandberg JK.Trends Immunol (2010) 31(11):401–6
19.Della Chiesa M, et.al, Front Immunol (2015) 6:573
20.Chiossone L, et.al, Blood. (2009)113(22):5488-96
21.Hayakawa Y, Smyth MJ.J Immunol. (2006) 176(3):1517-24